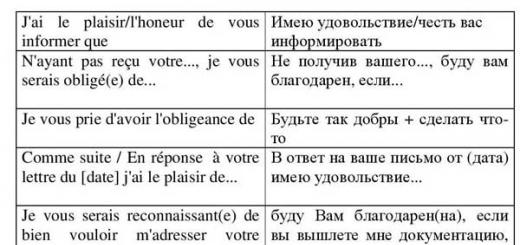
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА КАТИОНЫ
Катион
Воздействие или реактив
Признаки
Li +
Пламя
Na +
Пламя
Желтое окрашивание
К +
Пламя
Фиолетовое окрашивание
Са 2+
Пламя
Кирпично-красное окрашивание
Sr 2+
Пламя
Карминово-красное окрашивание
Ва 2+
S0 4 2-
Выпадение белого осадка, не растворимого в кислотах: Ва 2+ + S0 4 2- BaS0 4
Пламя
Желто-зеленое окрашивание
Сu 2+
Вода
Гидратированные ионы Сu 2+ имеют голубую окраску
ОН -
Осадок голубого цвета Сu 2+ +2ОН - → Сu (OH ) 2 ↓
РЬ 2+
S 2-
Аg+
Cl -
Выпадение белого осадка; не растворимого в HNO 3 , но растворимого в конц.
NH 3 Н 2 0:
Аg+ +Cl - AgCl
Fe 2+
гексацианоферрат (III) калия (красная кровяная соль) K 3
Выпадение синего осадка:
К + + Fe 2+ + 3- KFe 4
3Fe 2+ +2 3- Fe 3 2
ОН -
Объемный хлопьевидный осадок белого(светло-зеленого) цвета, буреющий на воздухе в результате окисления Fe 2+ +2ОН - → Fe(OH ) 2 ↓
Fe 3+
гексацианоферрат (II) калия (желтая
кровяная соль)
K 4
Выпадение синего осадка:
К+ + Fe 3+ + 4- KFe
4Fe 3+ + 3 4- Fe 4 3
роданид-ион
NCS -
Появление ярко-красного окрашивания Fe 3+ +3NCS - =Fe (NCS ) 3
ОН -
Объемный хлопьевидный осадок бурого цвета Fe 3+ +3ОН - → Fe(OH ) 3 ↓
Al 3+
щелочь (амфотерные свойства гидроксида)
Выпадение объемного осадка белого цвета, растворяющийся в избытке щелочи и растворах кислот Al 3+ +3ОН - → Al(OH ) 3 ↓
Zn 2+
ОН -
Выпадение объемного осадка белого цвета, растворяющийся в избытке щелочи и растворах кислот Zn 2+ +2ОН - → Zn(OH ) 2 ↓
NH 4 +
щелочь, нагревание
Запах аммиака: NH 4 + + ОН - NH 3 + Н 2 0
Н +
(кислая среда)
Индикаторы: лакмус, метиловый оранжевый
красное окрашивание
красное окрашивание
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА АНИОНЫ
Анион
Реактив
Признаки
S0 4 2-
Ва 2+ (растворимые соли бария)
Выпадение белого осадка, нерастворимого в кислотах:
Ва 2+ + S0 4 2- BaS0 4
N0 3 -
конц. H 2 S O 4 и Си
Образование голубого раствора, содержащего ионы Сu
2+
, выделение газа бурого цвета (NO
2
)
Cu
+
4H
N
O
3
Cu
(NO
3
)
2
+ 2NO
2
+ 2Н
2
0
РО 4 3-
ионы Ag +
Выпадение светло-желтого осадка в нейтральной среде: ЗАg+ + Р0 4 3- Аg 3 Р0 4
СrO 4 2-
ионы Ва 2+
Выпадение желтого осадка, не растворимого в уксусной кислоте, но растворимого в HCI: Ва 2+ + СrO 4 2- BaCr0 4
S 2-
ионы РЬ 2+
Выпадение черного осадка: Pb 2+ + S 2- PbS
Н + (растворы кислот)
Выделение газа с запахом тухлых яиц 2H + + S 2- → H 2 S
СО 3 2-
ионы Н +
Выделение газа 2Н + + СO 3 2- Н 2 0 + С0 2
ионы Са 2+
выпадение белого осадка, растворимого в
кислотах: Са 2+ + С0 3 2- = СаСОз
SO 3 2-
ионы Н +
Появление характерного запаха S0 2: 2Н + + SO 3 2- Н 2 0 + S0 2
Si O 3 2-
ионы Н +
Выпадение студенистого осадка 2Н + + Si O 3 2- H 2 SiO 3 ↓
F -
ионы Са 2+
Выпадение-белого осадка: Са 2+ + 2F - CaF 2
Cl -
ионы Аg +
Выпадение белого осадка, не растворимого в HN03, но растворимого в конц. NH 3 Н 2 0: Аg + +CI - AgCl
AgCI + 2(NH 3 Н 2 0) + + CI - + 2Н 2 О
Br -
ионы Аg +
Выпадение светло-желтого осадка, не растворимого в HN0 3: Ag + + Br - = AgBr осадок темнеет на свету
I -
ионы Аg +
Выпадение желтого осадка, не растворимого в HNO 3 и NH 3 конц.: Аg+ + I - АgI осадок темнеет на свету
ОН -
(щелочная среда )
индикаторы: лакмус
фенолфталеин
синее окрашивание,
малиновое окрашивание
ОПРЕДЕЛЕНИЕ НЕКОТОРЫХ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
Вещество
Реагент
Признаки протекания реакции
CO 2 газ без цвета и запаха, не ядовит, растворим в воде
известковая вода Са(ОН) 2
Са(ОН) 2 + С0 2 СаСО 3 + Н 2 0, СаСО 3 + С0 2 + Н 2 0 Са(НС0 3) 2 Выпадение белого осадка и его растворение при пропускании изб. С0 2
баритовая вода Ba (OH ) 2
B а(ОН) 2 + С0 2 BаСО 3 + Н 2 0, BаСО 3 + С0 2 + Н 2 0 Bа(НС0 3) 2 Выпадение белого осадка и его растворение при пропускании изб. С0 2
SO 2 газ без цвета, с резким запахом, ядовит, растворим в воде
известковая вода Са(ОН) 2
Са(ОН) 2 + S 0 2 СаSО 3 + Н 2 0, СаSО 3 + S 0 2 + Н 2 0 Са(НS0 3) 2 Выпадение белого осадка и его растворение при пропускании изб. S0 2
баритовая вода Ba (OH ) 2
B а(ОН) 2 + S0 2 BаSО 3 + Н 2 0, BаSО 3 + S0 2 + Н 2 0 Bа(НS0 3) 2 Выпадение белого осадка и его растворение при пропускании изб. S0 2
H 2 S газ без цвета, с запахом тухлых яиц, ядовит, растворим в воде
Растворимые соли Pb 2+ , Cu 2+ , Ag +
Образуются осадки черного цвета, нерастворимые в растворах кислот, которые растворяются при нагревании в конц. HNO 3 Pb 2+ + H 2 S = PbS +2H +
Cu 2+ + H 2 S = CuS +2H +
2Ag + + H 2 S = Ag 2 S +2H +
NH 3 газ без цвета, с резким запахом, очень хорошо растворим в воде, ядовит
Н 2 0, индикаторы
Раствор аммиака (аммиачная вода, нашатырный спирт) окрашивает индикаторы: лакмус – в синий цвет, метилоранж – в желтый, фенолфталеин – в малиновый.
HCl (газ)
Образуется белый дым
NH 3 + HCl = NH 4 Cl
O 2 газ без цвета и запаха, мало растворим в воде
Тлеющая лучинка
Тлеющая лучинка загорается
C + O 2 = CO 2
«Типы химических связей» - Вещества с атомной кристаллической решеткой. ЭО атома, условная величина, характеризующая способность атома в молекуле притягивать электроны. Образование полярной и неполярной связи. Кристаллы твердые, тугоплавкие, без запаха, в воде нерастворимы. Если е - присоединяются – ион заряжается отрицательно.
«Степени окисления соединений» - Название. Составить формулы бинарных соединений. Положительная степень окисления. Оксид железа. Составить формулы веществ. Степень окисления. Бинарное соединение. Степени окисления элементов. Названия бинарных соединений. Определить степени окисления элементов в соединениях. Возможные отрицательные степени окисления.
«Ионная связь» - Проблемный вопрос: Путь к вершине химической пирамиды – ионная химическая связь в соединениях. Найдите выигрышный путь, который составляют вещества с ионной связью. Распределение ионов металлов в организме человека. Поиграйте в «крестики-нолики». Как атомы могут принимать устойчивые электронные конфигурации?
«Химия «Химическая связь»» - Ионная связь – это электростатическое притяжение между ионами. Параметры ковалентной связи. Ковалентная связь. Резких границ между разными видами химических связей нет. Водородная химическая связь. Два типа кристаллических решеток. Виды химической связи и типы кристаллических решеток. Число общих электронных пар равно числу связей между двумя атомами.
«Водородная связь» - Внутримолекулярная водородная связь. Электромагнитное излучение. 5)водородные связи способствуют образованию кристаллов в виде снежинок или измороси. Водородная связь. Особые свойства веществ, образованных межмолекулярной водородной связью. 1)между молекулами воды. Высокие температуры. Вибрации. 2)между молекулами аммиака.
«Виды химической связи» - I.Выпишите формулы веществ: 1.с К.Н.С. 2.с К.П.С. 3. с И.С. Определите вид химической связи. Какая реакция является окислительно-восстановительной? Окисление. Виды химической связи. Ионная решетка. Ионная. Определите в каком веществе степень окисления серы равна +4. Виды связи и типы решеток. Итог. Ионная связь.
Всего в теме 23 презентации
Опыт 1. Обнаружение сульфат-ионов
В одну пробирку налейте 1-2 мл раствора сульфата натрия, а в другую - 1-2 мл раствора сульфата калия. В обе пробирки по каплям добавьте раствор хлорида бария. Объясните наблюдаемое.
Составьте уравнения электролитической диссоциации взятых солей и уравнение реакции обмена. Запишите полное и сокращённое ионные уравнения реакции.
Какие соединения могут служить реактивом на ионы бария Ва 2+ ?
В чём сущность обнаружения ионов с помощью реактива?
Опыт 2. Обнаружение хлорид-ионов Сl -
По таблице растворимости выясните, какие соли, содержащие хлорид-ион Сl - , нерастворимы (малорастворимы). При помощи имеющихся у вас реактивов докажите, что в растворе хлорида натрия присутствуют хлорид-ионы.
Составьте уравнения диссоциации солей, реакции обмена и полные и сокращённые ионные уравнения проведённых реакций.
Опыт 3. Обнаружение сульфат-ионов и хлорид-ионов Сl -
В двух пробирках содержатся растворы хлорида калия и сульфата магния. С помощью каких реакций можно доказать, что в одной пробирке находится раствор хлорида калия, а в другой - раствор сульфата магния?
Раствор из первой пробирки разделите пополам и перелейте в две пробирки. Прилейте в одну пробирку раствор нитрата свинца (II), в другую - раствор хлорида бария. В какой из пробирок выпал осадок? Какая из солей - КСl или MgSO 4 - содержится в первой пробирке?
Раствор из второй пробирки испытайте на присутствие аниона, не обнаруженного в первой пробирке. Для этого к испытуемому раствору прилейте раствор нитрата свинца (II). Объясните наблюдаемое.
Составьте уравнения реакций обмена проведённых вами реакций и полные и сокращённые ионные уравнения реакций обнаружения ионов.
Опыт 4
Проделайте реакции, подтверждающие качественный состав следующих веществ: а) хлорида бария; б) сульфата магния; в) карбоната аммония. Для выполнения этого опыта используйте таблицу 12.
Таблица 12
Определение ионов



А) Определение хлорид-ионов
Ионометрический анализ природной и питьевой воды на содержание ионов основан на измерении величины равновесного потенциала ионоселективного мембранного электрода, погруженного в раствор анализируемого иона. Потенциал измеряют относительно электрода сравнения, снабженного солевым мостиком, заполненным 1М раствором нитрата калия, с помощью мономера (см. рис. 12.1).
При потенциометрических измерениях, проводимых для определения концентраций отдельных веществ методом прямой потенциометрии или методом потенциометрического титрования, монтируют ячейку, состоящую из индикаторного электрода и электрода сравнения. Как правило, она представляет собой обычный химический стакан. Раствор в ячейке перемешивают при помощи механической или магнитной мешалки.
Концентрацию анализируемого иона находят по калибровочному графику. График строят в координатах «Е - (-lgС)».
Оборудование и реагенты
Ионоселективный электрод на ион С1 .
Пипетки мерные на 10 мл.
Стаканы стеклянные на 100, 250 мл.
Бумага фильтровальная.
Хлорид калия.
Нитрат калия, 1М раствор.
По точной навеске готовят серию стандартных растворов хлорида калия (10 "-10 ’М) с постоянной ионной силой, создаваемой 1М раствором нитрата калия. Снимают зависимость потенциала ионоселективного электрода от концентрации хлорида калия и строят калибровочный график. Измерения проводят в порядке возрастания концентрации растворов. После каждого измерения электроды промывают дистиллированной водой и осушают фильтровальной бумагой. По результатам измерений строят калибровочный график.
С х (моль/л) хлорид-ионов в питьевой и природной воде, пользуясь построенным калибровочным графиком.
Концентрацию хлорид-ионов (г/л) вычисляют в граммах по формуле
Результаты измерений заносят в форму табл. 12.8.
Таблица 12.8
Результаты ионометрического определения ионов хлора в воде
Б) Определение фторид-ионов
При анализе природных и производственных объектов следует помнить, что ион F в кислых растворах или в присутствии ионов Fe 3+ и Л1 3+ находится в виде слабодиссоциирующей кислоты HF и фторидных комплексов указанных металлов. Поэтому в растворе доводят pH до значения 5-7, а также добавляют цитрат натрия, который образует с ионами железа и алюминия более прочные комплексы.
Оборудование и реагенты
Индикаторный электрод - ионоселективный электрод на ион F . Перед работой выдерживают электрод в 0,001М NaF в течение суток. Перед измерением промывают и оставляют на 10-20 мин в дистиллированной воде, затем высушивают фильтровальной бумагой.
Электрод сравнения, хлоридсеребряный.
Стаканы полиэтиленовые емкостью от 50 мл.
Колбы мерные, на 100 мл 6 шт., на 1000 мл 1 шт.
Цилиндры емкостью 50, 100, 1000 мл.
Пипетки мерные на 10 и 25 мл.
Стандартный раствор - 0,1 М раствор фторида натрия (навеску 4,200 г растворяют в мерной колбе емкостью 1000 мл).
Фоновый раствор - 1М раствор сульфат натрия (навеску 142 г Na 2 S0 4 или 322 г Na 2 S0 4 ? ЮН 2 0 растворяют в мерной колбе емкостью 1000 мл).
Азотная кислота, 0,01М раствор.
Аммиак, 0,01М водный раствор.
Описание определения
При подготовке растворов к измерениям в стандартные и анализируемые растворы вводят одинаковый избыток фонового электролита. В этом случае можно полагать, что во всех растворах ионная сила постоянна.
Из основного стандартного раствора с концентрацией фторид-иона 10 "М готовят последовательным разбавлением его раствором 1М Na 2 S0 4 шесть растворов с концентрациями NaF (М): 10 ", 10" 2 , 10 3 , 10 10 5 , 10 6 . Для этого отбирают пипеткой 10 мл 10 "М раствора NaF в мерную колбу на 100 мл и доводят фоновым раствором (1М Na 2 S0 4) объем до метки. Из полученного раствора 10 2 М NaF последовательным разбавлением фоновым раствором по аналогичной методике готовят остальные растворы. Начиная с раствора с наименьшей концентрацией последовательно во всех стандартных растворах измеряют потенциал фторселективного электрода и результаты измерений записывают в форму таблицы, аналогичной табл. 9.8. По результатам измерений строят калибровочный график.
При определении концентрации фторид-иона в анализируемом растворе необходимо приготовить раствор с той же ионной силой. Для этого 5 мл исследуемого раствора разводят 1М Na 2 S0 4 в колбе на 50 мл. Индикаторной бумагой проверяют pH и доводят его 0,01М HNO:j или NH 4 OH до значения 5,0-5,5.
Измеряют потенциал фторселективного электрода в этом растворе. По калибровочному графику определяют значение рХ = -lg. Результаты записывают в форму таблицы.
Следует определить содержание фторид-иона в контрольных задачах, проверить ответ у преподавателя и вычислить относительную погрешность измерений.
В) Определение нитрат-ионов
Ионометрический анализ природной и питьевой воды на содержание нитрат-ионов основан на измерении величины равновесного потенциала ионоселективного мембранного электрода, погруженного в раствор анализируемого иона. В состав мембраны входит жидкий ионообменник с четвертичными аммониевыми солями. Потенциал измеряют на мономере относительно хлоридсеребряного электрода, заполненного насыщенным раствором хлорида калия.
Оборудование и реагенты
Ионоселективный электрод на ион NQ.,-hoh.
Хлоридсеребряный электрод сравнения.
Пипетки на 10 мл.
Стаканы стеклянные на 100 и 250 мл.
Хлорид калия.
Нитрат калия, 10 "М раствор.
Сульфат калия, 1М раствор.
1. Определение нитрат-ионов по методу калибровочного графика.
По точной навеске готовят стандартный раствор нитрата калия 10 "М. Последовательным разбавлением исходного стандартного раствора готовят растворы 10 2 -10 5 М с постоянной ионной силой, создаваемой 1М раствором сульфата калия (фон Л). Снимают зависимость потенциала ионоселективного электрода от концентрации нитрата калия. Результаты измерений вносят в форму таблицы, аналогичной табл. 9.8. Строят калибровочный график. Измерения проводят в порядке возрастания концентрации растворов. После каждого измерения электроды промывают дистиллированной водой и осушают фильтровальной бумагой.
Измеряют значения равновесных потенциалов анализируемых растворов. Определяют концентрацию С х (моль/л) нитратов в питьевой и природной воде, пользуясь построенным калибровочным графиком. Результаты вносят в форму таблицы.
Концентрацию нитрат-ионов в г/л вычисляют по формуле
где М(N0 3) - молярная масса иона, равная 62,01 г/моль.
2. Определение нитрат-ионов по методу добавок.
По точной навеске готовят стандартный 10 "М раствор нитрата калия. Последовательным разбавлением исходного стандартного раствора готовят растворы с концентрациями 10 2 -10 J M с постоянной ионной силой, создаваемой 1М раствором сульфата калия (фон А). Снимают зависимость потенциала ионоселективного электрода от концентрации нитрата калия и строят калибровочный график. Измерения проводят в порядке возрастания концентрации раствора. После каждого измерения электроды промывают дистиллированной водой и осушают фильтровальной бумагой. Результаты измерений оформляют в форме табл. 12.9.
Таблица 12.9
Результаты измерения потенциала в зависимости от pNO: , для построения калибровочного графика
Значение ионной силы рассчитывают для каждого раствора по формуле

Чем больше ионная сила раствора, тем меньше коэффициент активности каждого иона и меньше его активная концентрация.
Коэффициент активности находят по табличным данным (табл. 12.10) или по формуле Дебая - Гюккеля
![]()
Значения коэффициентов активности
Значение pN0 3 вычисляют как отрицательный логарифм активности нитрат-иона:
Строят график зависимости «Е - pN0 3 » и определяют крутизну (5) электродной функции (в милливольтах). Полученное значение крутизны используют в расчетной формуле в методе добавок. Следует отметить, как оно отличается от теоретического значения (0,0591/и при 25°С).
Для определения концентрации нитрит-иона в анализируемой пробе необходимо измерить потенциал (/;) до и после добавок стандартного раствора KNO ;j . Для этого аликвотную часть 20,00 мл анализируемого раствора помещают в сухой стакан, опускают в него электроды и измеряют потенциал (?,). Затем добавляют по 2-3 капли стандартного раствора KN0 3 , пользуясь микропипеткой на 1-2 мл. После каждой добавки перемешивают раствор магнитной мешалкой. Затем измеряют потенциал (? 2) и определяют его изменение по отношению к анализируемому раствору (ДЕ = Е., - ?,). Добиваются изменения АЕ не менее чем на 30 мВ, вводя 2-3 добавки к одной порции образца.
Рассчитывают результат определения по нескольким добавкам, зная объем Р ст добавленного раствора с концентрацией С ст, объем анализируемого раствора V r (20 мл) и пренебрегая разбавлением, по формуле

где АЕ - наблюдаемое изменение потенциала после добавки, мВ; 5 - крутизна электродной функции, установленная по графику, мВ. Содержание нитрат-ионов (в г/л) в анализируемом растворе вычисляют по формуле
![]()
где M(NQ 3) - молярная масса иона, равная 62,01 г/моль.
Вода относится к тем веществам, без которых существование жизни, в частности человека, на Земле невозможно. Качество употребляемой человеком воды непосредственно сказывается на его здоровье и, как следствие, на продолжительности жизни. Так, использование в быту воды без должной очистки может стать причиной возникновения эпидемий холеры и ряда других не менее опасных заболеваний.
Недопустимо
присутствие в воде солей тяжелых
металлов, так как все они в той или иной
мере токсичны и могут накапливаться в
человеческом организме. С этой точки
зрения особую опасность представляют
ртуть, свинец, кадмий, медь и хром.
Содержание железа в воде обычно достаточно
велико, поэтому, хотя оно и не относится
к тяжелым металлам, его тоже включают
в список элементов, подлежащих контролю.
При этом в воде могут находиться как
окрашенные ионы (





 и др.), присутствие которых сравнительно
легко обнаруживается по характерной
окраске воды, так и бесцветные (
и др.), присутствие которых сравнительно
легко обнаруживается по характерной
окраске воды, так и бесцветные (




 ),
присутствие которых устанавливается
только при помощи специальных химических
реакций.
),
присутствие которых устанавливается
только при помощи специальных химических
реакций.
Бесцветные ионы Цинк
Цинк относится к элементам с сравнительно низкой токсичностью, однако его избыток может привести к острым кишечным заболеваниям и рвоте. Источниками поступления цинка в природную воду являются отходы металлургической промышленности, продукты коррозии сплавов и цинковых покрытий, рудные воды.
Предельно допустимая концентрация цинка в природной воде составляет 5 мг/л.
Опыт 1. Определение цинка
а) Определение сульфидом натрия.
При добавлении к
раствору, содержащему катионы
 ,
сульфида натрия образуется белый осадок
сульфида цинка
,
сульфида натрия образуется белый осадок
сульфида цинка
 .
.
Это единственный из известных катионов металлов, образующий сульфид белого цвета.
Добавьте к нескольким каплям исследуемого раствора 2 - 3 капли раствора сульфида натрия. Запишите результаты опыта (опыт проводить под тягой!).
б) Определение щелочами.
При действии
сильных гидроксидов (щелочей)
 или
или на раствор, содержащий катионы цинка,
образуется белый осадок гидроксида
цинка
на раствор, содержащий катионы цинка,
образуется белый осадок гидроксида
цинка ,
растворимый благодаря своим амфотерным
свойствам и в кислотах, и в щелочах:
,
растворимый благодаря своим амфотерным
свойствам и в кислотах, и в щелочах:
В отличие от
алюминатов, при действии на раствор,
содержащий
 ,
хлорида аммония образование осадка
гидроксида цинка не происходит, потому
что последний растворим в солях аммония.
,
хлорида аммония образование осадка
гидроксида цинка не происходит, потому
что последний растворим в солях аммония.
Налейте в пробирку раствор, содержащий катионы цинка, несколько капель 2 н раствора щелочи до появления белого осадка, а затем избыток щелочи до его растворения. Запишите результаты опыта.
в) Определение
гексацианоферратом (II) калия
 .
.
Указанный реактив образует с катионами цинка белый осадок двойной соли
растворимый в щелочах.
Добавьте к раствору
соли цинка 2 - 3 капли раствора
 .
Запишите результаты опыта.
.
Запишите результаты опыта.
Кадмий относится к наиболее токсичным элементам. Он накапливается в организме и очень медленно выводится из него. Период, за который концентрация адсорбированного организмом кадмия уменьшится вдвое, превышает 10 лет.
Накопление в организме кадмия приводит к образованию камней в почках, гипертонии, уменьшению гемоглобина в крови, разрушению нервной системы.
Основными источниками поступления кадмия в окружающую среду являются кадмиевые покрытия, аккумуляторы, сигаретный дым. Достаточно сказать, что кровь курильщиков содержит приблизительно в 7 раз больше кадмия, чем кровь некурящих.
Предельно допустимая концентрация кадмия в природной воде составляет 0,001 мг/л.